近日,我校药学院、生物反应器工程国家重点实验室、光遗传学与合成生物学交叉学科研究中心杨弋教授团队在蛋白质光遗传学控制技术研究中取得突破性进展,在国际学术期刊《nature communications》发表题为“controlling protein stability with suli, a highly sensitive tag for stabilization upon light induction”的研究文章。

基因编辑、转录调控和rna干扰是目前广泛应用的活细胞蛋白质操纵方法,可以用于研究特定蛋白在复杂生物过程中的功能。特别是crispr-cas系统,其作为一种灵活和强大的基因组编辑工具,近年来得到了极为广泛的应用。然而,这些技术均是在基因或mrna水平对蛋白质进行控制,而mrna转录生成和翻译均需要时间,使得这些方法在表型控制方面存在有较大的延迟。内源性细胞蛋白可以在蛋白酶体靶向的情况下,通过蛋白酶体靶向的嵌合分子(protacs)或通过降解特定的抗体和抗体受体来进行快速降解。然而,发展这些蛋白特异的小分子诱导物或者抗体耗时较长且价格高昂,而且它们在生物体内自由扩散,一旦加入便很难从生物系统中去除,导致蛋白质调控的可逆性差。因此,发展可以直接在蛋白水平对蛋白质进行高时空分辨调控的工具是至关重要的。
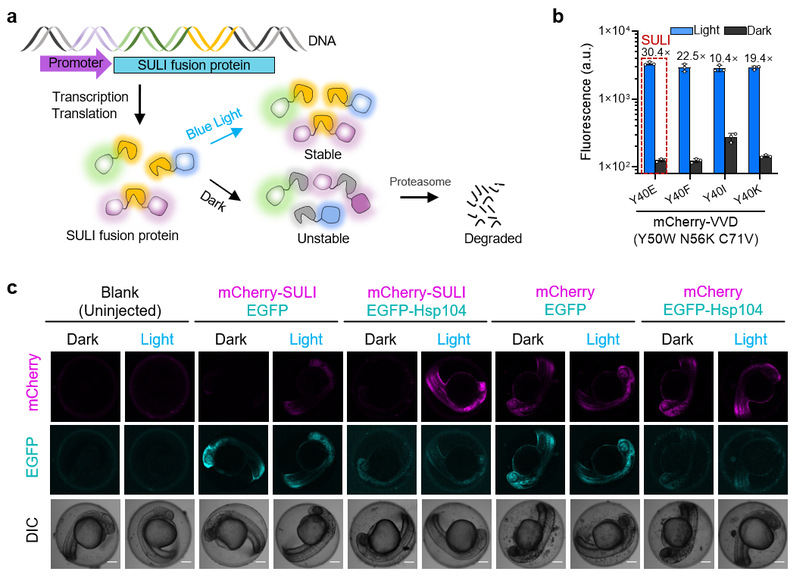
光由于其精确的时间和空间分辨率可以满足理想的蛋白质控制开关的几乎所有要求。迄今为止,科学家们已经设计出了多种光诱导降解子(lids),并成功应用于酵母、线虫、斑马鱼和哺乳动物细胞等模式生物中蛋白质降解的光遗传学精密调控。已报道的lids均包括一个来自高等植物蓝光敏感lov蛋白和一个c端降解子短肽(degron)。在黑暗条件下,lov蛋白的c端α螺旋与它的核心结构域相互作用,从而将降解子短肽保护起来,不被蛋白酶识别和降解。在蓝光照射下,lov蛋白的c端α螺旋与lov核心结构域解离,降解子短肽被释放出来,进而被并蛋白酶识别并降解。然而,这些lids即使在非诱导状态下也会破坏目标蛋白的稳定性,从而缩小了蛋白质水平的动态调控范围。此外,lids中的降解子短肽如鸟氨酸脱羧酶(odc)的c端序列和四氨基酸小肽rrrg,只能在蛋白质的c端起作用。因此,lids必须融合在目标蛋白质的c端,因此对于不耐受c端融合的蛋白质来说并不适用。因此,发展具有优良光诱导特性且更好通用性的光敏感蛋白质降解子仍是非常急迫且具有挑战性的。
在本研究中,研究团队基于光敏蛋白vvd发展了光诱导稳定的蛋白质降解标签suli(stabilization upon light induction)。在黑暗条件下,suli标签会被细胞的降解系统识别并降解;在蓝光照射下,suli标签则非常稳定。实验结果表明,suli可被用于调控多种报告蛋白的稳定性。更重要的是,suli可插入在目的蛋白的n端、c端甚至是内部来调控它们的稳定性。进一步研究结果表明,suli对目的蛋白的降解是光强依赖的,并且可以震荡式调控目的蛋白在细胞中的丰度。本研究还研究了suli介导蛋白质降解的分子机制。结果表明,suli是通过非赖氨酸泛素化依赖的蛋白酶体途径降解的,并且还伴随有聚集与去聚集过程。研究团队利用显微成像实验证明suli在其降解过程中会发生聚集,并在hsp104蛋白的辅助下完成去聚集并进入蛋白酶体完成降解过程。本研究随后利用suli调控酵母细胞内源蛋白sici的稳定性,实现酵母细胞周期的精确控制。此外,suli还可用于调控斑马鱼中蛋白质的稳定性,通过对pitx2蛋白稳定性的调控,本研究实现斑马鱼发育过程的精确控制。综上,suli为研究不同细胞过程中的蛋白质代谢和功能提供了一个强大而方便的工具。
该篇论文第一作者为茅缪伟博士(现为中国科学院上海营养与健康所副研究员)、钱亚杰博士与张文耀博士,通讯作者为杨弋教授和陈显军教授。该研究获得了中国科学院上海营养与健康所王泽峰研究员的大力支持。该研究得到了国家重点研发计划、国家自然科学基金、上海市细胞代谢光遗传学技术前沿科学研究基地、生物反应器工程国家重点实验室基金、教育部基本科研业务费等经费资助。
原文链接:https://www.nature.com/articles/s41467-023-37830-0